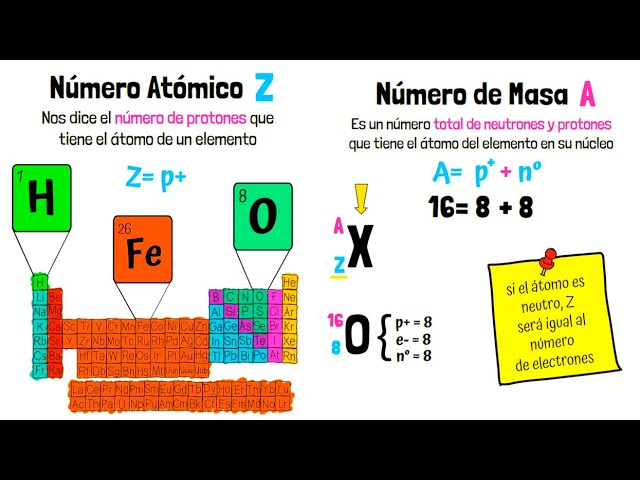
La masa atómica y el número atómico son dos conceptos fundamentales en la química y la física. Ambos están relacionados con las características de los átomos, que son las unidades fundamentales de la materia.
¿Qué es la masa atómica?
La masa atómica es una propiedad física de un átomo. Representa la masa de un átomo en unidades atómicas de masa (u) y está relacionada con la cantidad de partículas en el núcleo del átomo. Esto incluye protones y neutrones, ya que son las partículas que contribuyen a la masa del átomo. Los electrones, que orbitan alrededor del núcleo, tienen una masa mucho menor en comparación y generalmente se desprecian al calcular la masa atómica.
La masa atómica se expresa utilizando la unidad de masa atómica unificada, la cual es igual a 1/12 de la masa de un átomo de carbono-12. Esto significa que el carbono-12 tiene una masa atómica de exactamente 12 u. La masa atómica de otros átomos se determina comparando su masa con la masa del carbono-12.
Es importante mencionar que la masa atómica no es un número entero debido a la existencia de isótopos. Los isótopos son átomos de un mismo elemento que tienen diferente número de neutrones en su núcleo. Como los neutrones también contribuyen a la masa del átomo, diferentes isótopos de un elemento tendrán diferentes masas atómicas.
¿Qué es el número atómico?
El número atómico es una propiedad fundamental de un átomo y se representa con la letra “Z”. Este número está relacionado con la cantidad de protones en el núcleo de un átomo. Los protones son partículas cargadas positivamente y determinan las propiedades químicas del átomo, incluyendo su posición en la tabla periódica de los elementos.
El número atómico también determina el número de electrones en un átomo neutro, ya que los átomos generalmente tienen la misma cantidad de electrones y protones para mantener una carga equilibrada. Por lo tanto, el número atómico de un átomo también puede representar el número de electrones en un átomo neutro.
Relación entre la masa atómica y el número atómico
La masa atómica y el número atómico están relacionados de la siguiente manera:
La masa atómica de un átomo es aproximadamente igual a la suma de los protones y los neutrones en su núcleo. Como se mencionó anteriormente, los electrones tienen una masa mucho menor y no se consideran al calcular la masa atómica. Por lo tanto, la masa atómica de un átomo se puede estimar redondeando el número de masa (suma de protones y neutrones) al número entero más cercano.
Por ejemplo, un átomo de carbono-12 tiene 6 protones y 6 neutrones en su núcleo, por lo que su masa atómica es aproximadamente 12 u. Un átomo de oxígeno-16 tiene 8 protones y 8 neutrones, por lo que su masa atómica es aproximadamente 16 u. Esta relación entre el número de masa y la masa atómica es una forma conveniente de identificar y comparar átomos.
Importancia de la masa atómica y el número atómico
La masa atómica y el número atómico son propiedades clave que se utilizan en varios contextos científicos y prácticos:
1. Identificación de elementos:
El número atómico determina la identidad de un elemento químico. Cada elemento tiene un número atómico único que lo distingue de otros elementos. Por ejemplo, el carbono siempre tendrá un número atómico de 6 y el oxígeno un número atómico de 8. Esto permite identificar y clasificar los elementos en la tabla periódica.
2. Cálculo de la fórmula molecular:
La masa atómica se utiliza para calcular la masa total de una fórmula molecular. Una fórmula molecular muestra la proporción en la que se encuentran los diferentes átomos en una molécula compuesta. Al conocer las masas atómicas de los diferentes elementos en la fórmula, se puede calcular la masa total de la molécula.
3. Determinación de isotopos:
La masa atómica también se utiliza para determinar la existencia y abundancia de diferentes isótopos. Al comparar la masa atómica promedio de un elemento con diferentes muestras, se pueden identificar los isótopos presentes y su abundancia relativa.
Preguntas frecuentes
¿Cuál es la diferencia entre la masa atómica y la masa molecular?
La masa atómica se refiere a la masa promedio de un solo átomo de un elemento, mientras que la masa molecular se refiere a la masa promedio de una molécula compuesta por varios átomos. La masa molecular tiene en cuenta la masa de todos los átomos presentes en una molécula, incluyendo el número de átomos y sus masas individuales.
¿Qué es un isótopo?
Los isótopos son átomos de un mismo elemento que tienen un número diferente de neutrones en su núcleo. Esto significa que los isótopos tienen la misma cantidad de protones, pero difieren en su número de neutrones. Los isótopos de un elemento tienen propiedades similares debido a su estructura electrónica, pero pueden tener diferentes masas atómicas y propiedades nucleares.
¿Cómo se calcula la masa atómica promedio de un elemento?
La masa atómica promedio de un elemento se calcula teniendo en cuenta la abundancia relativa de sus isótopos y sus masas atómicas. Se multiplica la masa atómica de cada isótopo por su abundancia relativa y se suman los productos para obtener la masa atómica promedio. Esta es la masa que generalmente se muestra en la tabla periódica para un elemento dado.
¡Espero que este artículo te haya ayudado a comprender mejor el concepto de masa atómica y número atómico! Si tienes alguna pregunta adicional, ¡no dudes en dejarla en los comentarios!