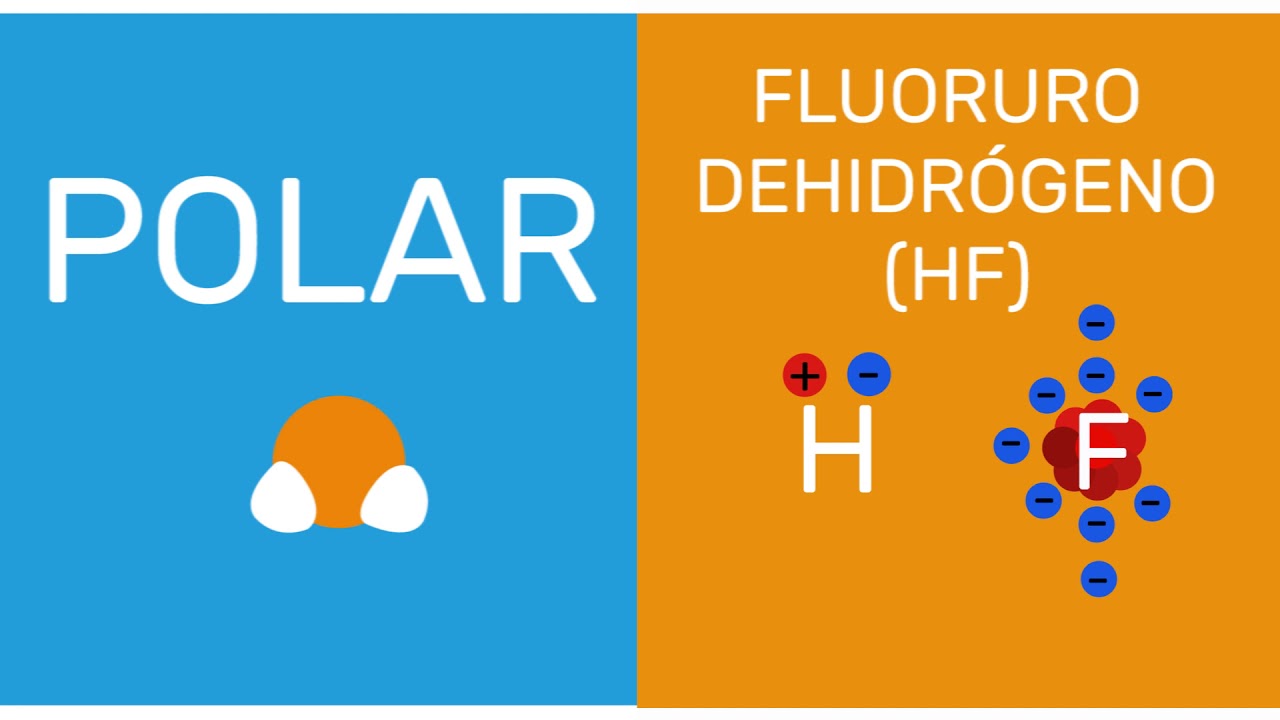
Una sustancia química puede ser clasificada como polar o apolar en función de la distribución de la carga eléctrica en sus moléculas. Esta distinción es fundamental en la química y tiene importantes implicaciones en diversos campos, desde la biología hasta la física. En este artículo profundizaremos en qué significa que una sustancia sea polar o apolar, cómo identificarlas y cómo estas propiedades influyen en su comportamiento.
Características de las Sustancias Polares
Las sustancias polares se caracterizan por tener una distribución asimétrica de la carga eléctrica en sus moléculas. Esto significa que presentan zonas con una mayor densidad electrónica negativa (polo negativo) y zonas con menor densidad electrónica (polo positivo). Un ejemplo clásico de una sustancia polar es el agua (H2O), donde el oxígeno tiene una mayor electronegatividad que el hidrógeno, generando la conocida molécula con forma de “V” y una leve carga eléctrica negativa en el oxígeno y positiva en los hidrógenos.
Propiedades Físicas de las Sustancias Polares
Las sustancias polares suelen tener puntos de ebullición y fusión más altos en comparación con las sustancias apolares debido a las interacciones de dipolo-dipolo entre sus moléculas. Estas interacciones son más fuertes que las fuerzas de dispersión presentes en las sustancias apolares, lo que resulta en una mayor energía requerida para romper los enlaces entre las moléculas.
Aplicaciones en la Vida Cotidiana
Las propiedades de las sustancias polares tienen aplicaciones prácticas en nuestra vida diaria. Por ejemplo, la polaridad del agua le confiere su capacidad de disolver una amplia variedad de sustancias, lo que la convierte en el “solvente universal”. Esta propiedad es fundamental para procesos biológicos como la digestión, donde el agua juega un papel crucial en la descomposición y absorción de nutrientes.
Diferencias con las Sustancias Apolares
Características de las Sustancias Apolares
Las sustancias apolares, por otro lado, presentan una distribución simétrica de la carga eléctrica en sus moléculas, lo que resulta en una falta de polos claramente definidos. Un ejemplo común de una sustancia apolar es el dióxido de carbono (CO2), donde la molécula tiene una forma lineal y una distribución equitativa de electrones entre el carbono y los átomos de oxígeno.
Propiedades Físicas de las Sustancias Apolares
Las sustancias apolares tienden a tener puntos de ebullición y fusión más bajos en comparación con las sustancias polares debido a las fuerzas de dispersión de London que predominan en este tipo de compuestos. Estas fuerzas son generadas por las fluctuaciones momentáneas en la distribución electrónica de las moléculas y son más débiles que las interacciones dipolo-dipolo presentes en las sustancias polares.
Aplicaciones en la Industria
Las sustancias apolares son utilizadas en la industria química como disolventes de sustancias no polares, lubricantes, y en la fabricación de productos como plásticos y ceras. Su baja polaridad las hace ideales para ciertas aplicaciones donde se requiere una interacción débil entre moléculas, como en el caso de los aceites lubricantes utilizados en maquinaria pesada.
Importancia en la Química y la Biología
Reacciones Químicas
La polaridad de las sustancias es fundamental en la determinación de la viabilidad de una reacción química. En general, las sustancias polares tienden a reaccionar entre sí, mientras que las sustancias apolares tienden a formar mezclas homogéneas. Esta selectividad en las interacciones químicas es clave en la síntesis de nuevos compuestos y materiales.
Biología Molecular
En biología molecular, la interacción entre moléculas polares y apolares juega un papel crucial en la conformación de las estructuras biológicas. Por ejemplo, las proteínas adoptan su forma tridimensional estable gracias a interacciones tanto polares como apolares entre los aminoácidos que las componen. Estas interacciones determinan la función de la proteína en el organismo.
Conclusiones
La distinción entre sustancias polares y apolares es esencial en la comprensión de diversas propiedades químicas y físicas de los compuestos. La polaridad de una sustancia influye en su solubilidad, densidad, temperatura de fusión y ebullición, entre otras características, lo que tiene amplias implicaciones en campos tan diversos como la química, la biología y la medicina.
Preguntas Frecuentes
¿Todas las sustancias son estrictamente polares o apolares?
Aunque la mayoría de las sustancias pueden clasificarse en base a su polaridad, existen casos intermedios donde la distinción no es tan clara. Algunas moléculas presentan grados variables de polaridad, lo que las sitúa en una zona gris entre ambos extremos.
¿Cómo afecta la polaridad de las sustancias a sus propiedades químicas y fisicoquímicas?
La polaridad de una sustancia determina su comportamiento en presencia de otras sustancias, su capacidad para formar enlaces intermoleculares y su interacción con campos eléctricos externos. Estas propiedades son fundamentales para comprender y predecir el comportamiento de los compuestos en diversas situaciones.
Mediante esta exploración de las sustancias polares y apolares, esperamos haber arrojado luz sobre una de las distinciones más relevantes en la química y haber demostrado cómo esta caracterización influye en la comprensión de las propiedades y comportamiento de los compuestos en diferentes contextos.